Introducción
La malacoplaquia es un proceso inflamatorio crónico granulomatoso, raro, que se presenta principalmente en pacientes inmunocomprometidos, con diabetes mellitus o neoplasias hematolinfoides1. Se cree que es causado principalmente por una falla de los macrófagos en la fagocitosis de microorganismos2,3. Este desorden puede diagnosticarse solamente mediante estudio histopatológico, en el cual se encuentran macrófagos con cuerpos de Michaelis-Gutmann, descritos en 1902 por Michaelis y Gutmann y mejor caracterizados en 1903 por von Hansemann, los cuales contienen calcio, hierro, bacterias intactas y degeneración dentro de los fagolisosomas, es por lo anterior que la asociación con los procesos infecciosos es bien conocida. Microorganismos como Escherichia coli y Klebsiella pneumoniae se aíslan comúnmente en este tipo de lesiones4.
La malacoplaquia tiene especial predilección por las vías urinarias, aunque puede presentarse en cualquier parte del cuerpo. En los últimos años los reportes de involucramiento de órganos como hueso, útero, próstata y pulmón han aumentado4. Dentro del aparato genitourinario la mayor parte de los casos se presenta en la vejiga, siendo una biopsia vesical el primer espécimen en el que se reportó la malacoplaquia. Actualmente la mayoría de los casos descritos de malacoplaquia vesical están asociados a antecedente de cultivos positivos para E. coli3.
El primer caso de malacoplaquia de localización prostática fue descrito por Carruthers en 19591,3. Para 1989 se habían descrito 200 casos de malacoplaquia, de los cuales 11 correspondieron a localización prostática, y para 2021 solo habían sido descritos 74 casos de malacoplaquia prostática en todo el mundo, por lo que se sigue considerando una enfermedad extremadamente rara.
Aun cuando se trata de una enfermedad inflamatoria y de naturaleza benigna, la malacoplaquia prostática se ha considerado una enfermedad que puede mimetizarse como carcinoma tanto en un tacto rectal anormal como en los estudios de última generación como la resonancia magnética (RM) multiparamétrica de próstata. Si bien los falsos positivos de lesiones PI-RADS (Prostate Imaging-Report and Data System) 5 se consideran moderadamente raros, alcanzando hasta el 14.7% de las biopsias con verdaderos PI-RADS 5, es importante mantener una alta sospecha, ya que el adecuado diagnóstico de esta y otras patologías benignas pueden evitar el sobretratamiento de los pacientes.
Caso clínico
Hombre de 69 años, quien presenta como único antecedente médico de importancia hiperuricemia manejada con alopurinol. Niega antecedentes familiares para cáncer de próstata. Inicia su padecimiento actual presentando retención aguda de orina dos meses antes de su ingreso, así como sintomatología de almacenamiento y vaciamiento vesical caracterizados por urgencia urinaria, tenesmo, disminución de fuerza y calibre de chorro urinario. Se le realizaron cinco recambios de sonda transuretral sin alteraciones o dificultades para su colocación. Dos días antes de su ingreso presenta alteración del estado general, astenia, adinamia y fiebre no cuantificada a pesar de encontrarse en manejo con levofloxacino por 10 días. Para este momento continúa con la vía urinaria derivada mediante sonda transuretral, por lo que acude a servicio de urgencias de nuestra institución, en donde se identifica hipotensión y bradicardia sintomática, requiriendo apoyo vasopresor e inotrópico, se inicia tratamiento antimicrobiano empírico con meropenem e ingreso a unidad de cuidados intensivos. A la exploración física dirigida, genitales acordes a edad y sexo, pene cilíndrico, meato central, con presencia de sonda transuretral 16 fr con gasto urinario claro sin sedimento, testículos intraescrotales sin alteración en morfología o consistencia, tacto rectal diferido. En sus estudios de laboratorio se destacan leucocitos de 8.23 103/ul, neutrófilos de 7.08 103/ul, proteína C reactiva de 11.69 mg/dl, procalcitonina de 31.6 ng/dl, antígeno prostático específico de 8.35 ng/ml, glucosa de 200 mg/dl, con una histórica de 99 mg/dl, creatinina de 0.79 mg/dl y dímero D de 3,009 ug/ml. Prueba de reacción en cadena de la polimerasa/antígeno coronavirus 2 del síndrome respiratorio agudo grave (SARS-CoV-2): negativo. El examen general de orina muestra: color amarillo, aspecto claro, gravedad 1.019, osmolaridad 665, pH 5, nitritos (–), esterasa leucocitaria (–), proteínas, glucosa (–), cetonas (–), urobilinógeno (–), bilirrubinas (–), hemoglobina 0.06, leucocitos 7, eritrocitos16, células epiteliales 7, bacterias 65, cristales (–), levaduras (–), filamento mucoide (–), cilindros (–), pseudohifas (–). El urocultivo y hemocultivo fue positivo para E. coli (Tabla 1). Posterior a la estabilización del paciente se realizó RM multiparamétrica de próstata con equipo de 3 Teslas por sospecha de absceso prostático, en la cual se observa próstata de 99 g, dos lesiones prostáticas, la primera en tercio superior y medio, y parcial del tercio inferior (tamaño 15 mm), categoría PI-RADS 5, la segunda en zona transicional izquierda (tamaño 29 mm) categoría PI-RADS 4, y la tercera en tercio inferior derecho de zona transicional a considerar absceso (tamaño 20 mm), categoría PI-RADS 2. Ganglios pélvicos en cadena obturatriz, paravesicales y pararrectales (Figs. 1 y 2).
Tabla 1. Resultados de estudios de laboratorio al ingreso
| Parámetro | Resultado | Unidad de medida |
|---|---|---|
| Leucocitos | 8.23 | 103/ul |
| Neutrófilos | 7.08 | 103/ul |
| Proteína C reactiva | 11.69 | mg/dl |
| Procalcitonina | 31.6 | ng/dl |
| Antígeno prostático específico | 8.35 | ng/ml |
| Glucosa | 200 | mg/dl |
| Creatinina | 0.79 | mg/dl |
| Dímero D | 3009 | ug/ml |
| PCR/antígeno SARS-CoV-2 | Negativo | Positivo/negativo |
| Examen general de orina | ||
| Bacterias | 65 | x campo |
| Células epiteliales | 7 | x campo |
| Eritrocitos | 16 | x campo |
| Leucocitos | 7 | x campo |
|
PCR: prueba de reacción en cadena de la polimerasa; SARS-CoV-2: coronavirus 2 del síndrome respiratorio agudo grave. |
||
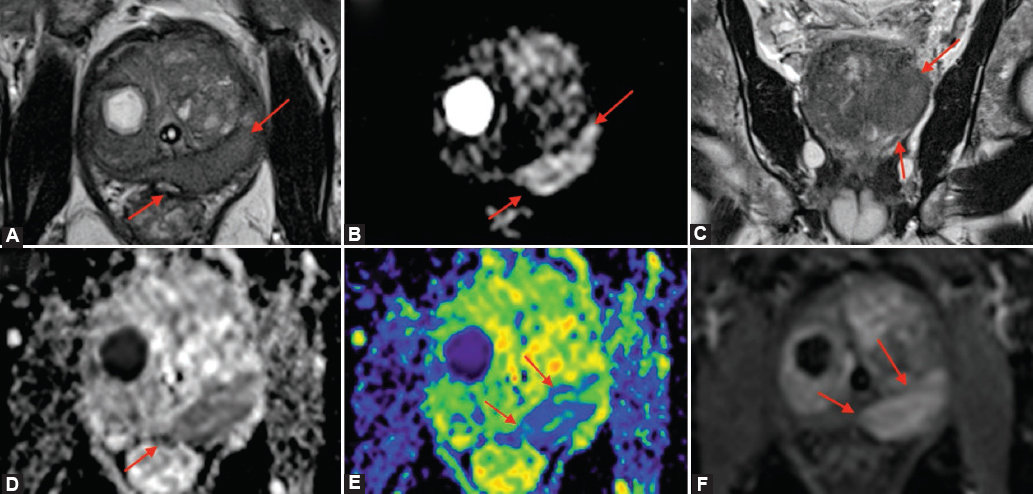
Figura 1. Paciente de 69 años con cuadros de prostatitis de repetición. Portador de sonda vesical. Resonancia magnética multiparamétrica. Lesión que muestra restricción molecular, (A-C) hiperintensa en difusión DWI (B), hipointensa heterogénea en el mapa de coeficiente de difusión aparente ADC (D), de 0.877 x10-3 mm2/s, y realce + (E, F), mide 28 mm. PI-RADS 5 de acuerdo con los criterios de PI-RADS (Prostate Imaging-Report and Data System) V2.1. Con sospecha alta de malignidad. Reporte histológico de zona flemonosa «prostatitis».

Figura 2. Paciente de 69 años con cuadros de prostatitis de repetición. Portador de sonda vesical. Resonancia magnética multiparamétrica. Absceso (flecha), imagen ovoidea multilobulada, colección intraprostática hiperintensa, heterogénea en secuencia T2 (A-D), hiperintenso en difusión (B), e hipointenso en ADC (E), con ADC de 0.877 x10-3 mm2/s, acentuada restricción molecular, con realce «en anillo» (E) y pared gruesa (F). En la periferia del absceso existe cambios extensos de prostatitis aguda, típica menor señal difusa en T2 y ADC, DWI leve hiperintensidad, y realce con contraste.
Con los hallazgos mencionados y tras cinco días de tratamiento antimicrobiano con carbapenémico, con adecuada respuesta clínica, se decide realizar destechamiento y drenaje del absceso prostático mediante resección transuretral bipolar, más toma de biopsia prostática transrectal guiada por ultrasonido de la lesión sospechosa PI-RADS 5. Se debe mencionar que durante este procedimiento la resección transuretral fue conservadora con la intención solo del drenaje del foco infeccioso y sin modificar la anatomía prostática de manera importante en caso de que el paciente requiriera un tratamiento radical en el escenario de un reporte de biopsia con enfermedad maligna.
En los cortes histológicos se identificó infiltrado inflamatorio linfohistocítico, con macrófagos de citoplasma amplio, vacuolado, con estructuras ovoides intracitoplasmática que con las tinciones de PAS y von Kossa fueron positivos, por lo tanto corresponden a cuerpos de Michaelis-Gutmann. Además, por inmunohistoquímica en estos sitios de la citoqueratina AE1/3 es negativa y el CD68 positivo en macrófagos, con reforzamiento alrededor de dichas estructuras (Figs. 2 y 3). El resto del tejido prostático presentó atrofia simple sin neoplasia maligna. Con los hallazgos descritos el diagnóstico fue de malacoplaquia.
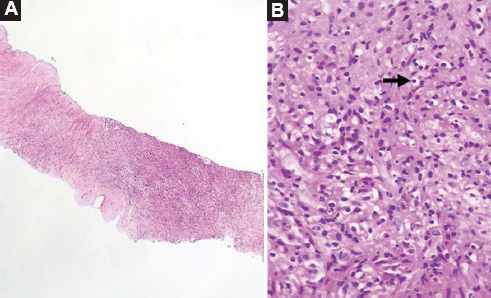
Figura 3. A: biopsia transrectal de próstata que muestra extenso infiltrado inflamatorio linfohistiocítico con escasos conductos prostáticos residuales (H y E, 40x). B: los macrófagos presentan material basófilo intracitoplasmático que corresponden a los cuerpos de Michaelis-Gutmann (flecha, H y E, 400x).
Debido a lo anterior, se considera que el paciente cursa con malacoplaquia prostática como parte del proceso infeccioso prostático, asociado a la infección por E. coli por lo que nos encontramos ante una entidad rara y benigna. Se decide entonces realizar una resección transuretral de próstata del tejido obstructivo residual cuatro semanas después del procedimiento inicial, donde los hallazgos morfológicos son similares a los de la biopsia transrectal.
Discusión
La malacoplaquia prostática es una entidad crónica e inflamatoria que se asocia fuertemente a la infección por E. coli, con hasta el 80-90% de aislamiento de esta bacteria en los cultivos4. La malacoplaquia prostática habitualmente se presenta con síntomas urinarios bajos y de forma más rara como se presentó en nuestro paciente, con retención aguda de orina, absceso prostático y choque séptico. Llama la atención de igual manera que el paciente no presentaba factores de riesgo asociados a esta patología como son la diabetes mellitus o algún otro tipo de inmunocompromiso4.
Debido a que la forma de presentación de esta enfermedad puede mimetizarse con otras enfermedades, principalmente con adenocarcinoma de próstata, con elevación de antígeno prostático específico y la presencia de lesiones sugerentes de malignidad en la RM multiparamétrica5, como fue en nuestro caso con una lesión PI-RADS 5, asociado además a un absceso prostático, lo que hace aún más rara la forma clínica en la que inició nuestro paciente, por lo que es importante para urólogos, imagenólogos y patólogos tener en mente esta entidad y así evitar tratamientos excesivos y radicales que puedan afectar a la calidad de vida de los pacientes de forma innecesaria5.
El diagnóstico de malacoplaquia se confirma con el estudio histopatológico, donde se identifica infiltrado inflamatorio crónico linfohistiocítico con presencia de material intracitoplasmático que contiene calcio y es positivo para la tinción de von Kossa (cuerpos de Michaelis-Gutmann) (Fig. 4) 6.
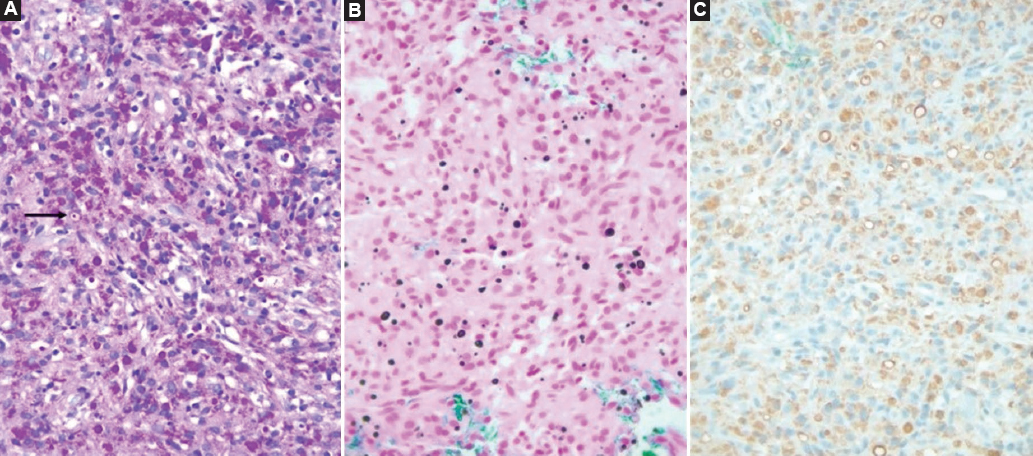
Figura 4. Biopsia transrectal de próstata que presenta cuerpos de Michaelis-Gutmann positivos con la tinción de PAS (A, 400x) y con la tinción de von Kossa (B, 400x). Por inmunohistoquímica los macrófagos son positivos al CD68 que muestra un defecto intracitoplasmático (C D68 inmunohistoquímica, 400x).
El tratamiento de la malacoplaquia una vez que se establece el diagnóstico con seguridad es con base en terapia antimicrobiana, según los reportes revisados el grupo farmacológico más utilizado son las fluoroquinolonas, sin embargo, teniendo en cuenta la gran resistencia local a este tipo de fármacos se optó por la utilización de carbapenémicos como primera opción, además de la gravedad del cuadro inicial. En casos raros como el nuestro es necesaria la utilización de la resección transuretral de próstata para el drenaje de abscesos una vez controlado el cuadro agudo de la infección6.
Según el reporte de Permpongkosol et al.2 hubo una desaparición de la lesión sospechosa PI-RADS 5 tras el tratamiento antimicrobiano en una RM multiparamétrica de seguimiento, sin embargo en nuestro caso no fue posible la realización de una nueva RM para confirmar este hallazgo.
Conclusión
La malacoplaquia prostática es un diagnóstico poco esperado en la práctica clínica, sin embargo puede camuflarse muy bien como adenocarcinoma prostático, imitando incluso las pruebas de mayor sensibilidad disponibles, como la RM multiparamétrica, por lo que debemos mantenernos alertas cuando el paciente presenta factores de riesgo asociados, como son infecciones por E. coli y algún grado de inmunocompromiso. Sin embargo debe notarse que en el caso de nuestro paciente se presentó una lesión PI-RADS 5, choque séptico y absceso prostático sin este último de factor de riesgo presente.
Hacer la distinción y diagnóstico de malacoplaquia prostática sobre el cáncer de próstata puede evitar el sobretratamiento, efectos adversos y deterioro de la calidad de vida de nuestros pacientes.
Financiamiento
Los autores declaran no haber recibido financiamiento para este estudio.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. Los autores han seguido los protocolos de confidencialidad de su institución, han obtenido el consentimiento informado de los pacientes, y cuentan con la aprobación del Comité de Ética. Se han seguido las recomendaciones de las guías SAGER, según la naturaleza del estudio.
Declaración del uso de inteligencia artificial. Los autores declaran que no han utilizado ningún tipo de inteligencia artificial generativa en la redacción de este manuscrito.
