Introducción
La rotura ventricular septal (RVS) es una complicación mecánica del infarto agudo de miocardio (IAM) con alta letalidad. El tratamiento de elección es la intervención quirúrgica; sin embargo, presenta una tasa de mortalidad muy elevada. La reparación temprana se recomienda generalmente cuando existe inestabilidad hemodinámica, no obstante, no se ha definido con precisión el tiempo indicado para establecer el manejo. Debido a la baja incidencia de esta afección, la mayoría de la información proviene de cohortes o registros nacionales de pacientes.
Presentación del caso
Presentamos el caso de un paciente de sexo masculino de 81 años enviado en contexto de síndrome coronario agudo de tipo IAM con desnivel positivo del segmento ST; cuenta con antecedente de hipertensión arterial sistémica de diez años de diagnóstico en tratamiento con antagonistas de los receptores de angiotensina II (ARA II), resto de crónico-degenerativos negados.
Inició padecimiento actual un día previo a su ingreso a las 18:00 h con dolor torácico opresivo, intensidad 10/10 en la escala visual analógica (EVA), acompañado de respuesta vagal caracterizad por diaforesis y náuseas. Acude al Hospital General a las 19:00 h con los siguientes signos vitales: tensión arterial (TA) 188/83 mmHg, frecuencia cardiaca (FC) 96 lpm, frecuencia respiratoria 22 rpm, saturación 96%. Se toma primer electrocardiograma (ECG) donde se observa desnivel positivo del segmento ST de V1-V4, se administra ácido acetilsalicílico, clopidogrel, atorvastatina y enoxaparina. Lo presentan a nuestra unidad en contexto de código infarto, ingresa 5 h con 50 min de inicio de su afección hemodinámicamente estable, dolor tipo anginoso 5/10, sin otra sintomatología agregada. Se toma nuevo ECG, donde se corrobora infarto anterior y a la auscultación se evidencia soplo en barra de predominio en ápex; se solicita ECG transtorácico donde se observa rotura del septum interventricular en porción apical de 5 mm, fracción de eyección del ventrículo izquierdo (FEVI) 45% y alteraciones de la movilidad (acinesia septoapical, lateroapical, inferoapical, anteroapical; hipocinesia inferoseptal segmento medio, acinesia anterior segmento medio y anteroseptal segmento medio). En el servicio de hemodinamia se realiza angiografía coronaria, se evidencia enfermedad de dos vasos principales: arteria descendente anterior (DA) con lesión suboclusiva del 99% en segmento medio y arteria descendente posterior con lesión en segmento distal focal del 75%. Se realiza intervención coronaria percutánea de la DA con colocación de stent XIENCE Sierra 3 × 38 mm con flujo final TIMI 3, y en un segundo tiempo se trabaja arteria coronaria derecha con colocación de stent Resolute Onyx 3 × 38 mm en segmento distal con flujo arterial normal (TIMI 3). Ingresa a unidad de cuidados intensivos cardiovasculares, se observa en nuevo ECG rotura del septum IV de 15 mm con cortocircuito de izquierda a derecha con diferencia de presiones de 3:1. Durante su estancia se realiza sesión médico-quirúrgica, siendo aceptado para cierre de defecto con parche de pericardio, acordando realizarse tres semanas posterior a IAM. El día 21 posterior a a la rotura del septum interventricular presenta deterioro hemodinámico, datos sugestivos de choque cardiogénico e insuficiencia cardiaca refractaria a tratamiento, por lo cual se inicia tratamiento con vasopresores. Se realiza taller hemodinámico, donde se evidencia disminución de resistencias vasculares periféricas, por lo que se presenta como cirugía de urgencia. Ingresa paciente a quirófano, se realiza abordaje por esternotomía media, canulación arterial y bicaval, se inicia derivación cardiopulmonar total y pinzamiento aórtico. Se realiza ventriculotomía derecha con corte paralelo al septum interventricular, se identifica el defecto de 3 × 2 cm (Fig. 1), se coloca parche de pericardio bovino (Fig. 2) y se cierra con puntos en U de Prolene 4-0 con pledgets (Fig. 3); posteriormente se realiza ventriculorrafia con técnica de sándwich con Prolene 2-0 con pledgets (Fig. 4). Los hallazgos transoperatorios observados fueron cardiomegalia grado III global, huella macroscópica de infarto en cara inferior y anterior, comunicación interventricular fenestrada apical de 3 × 2 cm. Ingresa a terapia posquirúrgica intubado y con apoyo aminérgico y vasopresor; se descanula a las 24 h y se retira el apoyo vasopresor a las 48 h. Egresa a hospitalización a las 72 h clínicamente estable, sin apoyo mecánico ventilatorio, sin apoyo vasopresor con presión arterial media limítrofe, afebril, sin datos de choque. Se realiza nuevo ECG de control donde se reporta defecto residual del cierre quirúrgico hemodinámicamente no significativo, FEVI del 32% y cardiomiopatía isquémica con daño miocárdico moderado. Presenta adecuada evolución posquirúrgica, por lo que egresa a domicilio sin complicaciones.
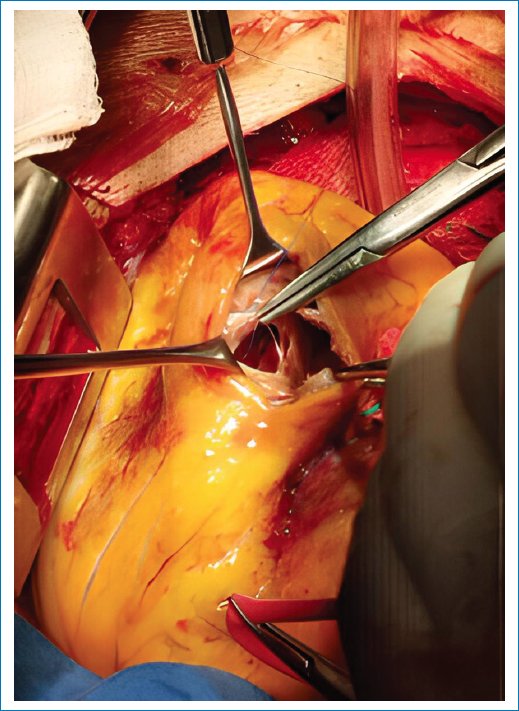
Figura 1. Defecto en septum interventricular.

Figura 2. Colocación de parche de pericardio bovino, defecto de 3 × 2 cm.

Figura 3. Cierre con puntos en U con pledgets.

Figura 4. Ventriculorrafia con técnica de sándwich con pledgets.
Discusión
La RVS es la complicación mecánica más común del IAM y conlleva una letalidad muy elevada; ocurre en aproximadamente el 0.21% de los infartos con elevación del segmento ST (IAMCEST) y en el 0.04% de los infartos sin elevación (IAMSEST)1.
Los factores de riesgo para desarrollar RVS post-IAM en esta era de reperfusión incluyen edad avanzada, sexo femenino, ausencia de tabaquismo, hipertensión, infarto ventricular derecho e IAM extenso2. En el reporte realizado por Elbadawi et al., obtenido de la base de datos del National Inpatient Sample (NIS) de 2003 a 2015, se evaluaron las complicaciones mecánicas derivadas del IAM con elevación y sin elevación del ST. La muestra incluyó 13,767 pacientes que presentaron complicaciones mecánicas, 10,344 (75%) desarrollaron RVS y el resto de los pacientes presentaron insuficiencia mitral aguda debido a la rotura del músculo papilar (19%) o por rotura de la pared libre (6%)3. El IAMCEST es más probable que esté asociado con el infarto transmural que el IAMSEST. Un IAM transmural es prerrequisito para RVS y, por lo tanto, es más común que ocurra tras un IAMCEST1. Esta complicación mecánica se presenta generalmente entre el segundo y sexto día, pero puede aparecer en cualquier momento en las dos semanas siguientes al infarto agudo. El tiempo promedio de aparición fue de un día en el estudio GUSTO-I (Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries), cuatro días en el estudio de la American Heart Association (AHA) de complicaciones mecánicas por IAM y 16 h en el estudio SHOCK4,5. Dependiendo de la presentación de la rotura septal (tamaño del infarto, el grado de shunt que presente y la insuficiencia ventricular derecha asociada), los pacientes pueden cursar con relativa estabilidad hemodinámica o con franco choque cardiogénico. El determinante más importante del resultado del manejo de la RVS es el desarrollo de insuficiencia cardiaca (izquierda, derecha o ambos) y el choque cardiogénico. La gravedad de la insuficiencia cardiaca está relacionada con la extensión de necrosis del miocardio y del shunt de izquierda a derecha1. El cierre quirúrgico es actualmente el tratamiento definitivo para la rotura septal ventricular postinfarto. El manejo generalmente involucra escisión de todo el tejido necrótico, colocación de parche en el defecto y revascularización miocárdica6. Sin tratamiento quirúrgico, el 90% de los pacientes morirá dentro de los dos meses siguientes4. Arnaoutakis et al. publicaron los resultados obtenidos de la cohorte (1999-2000) de la Base Nacional de Datos de la Society of Thoracic Surgeons (STS), donde estudiaron a 2,876 pacientes a los cuales se les realizó reparación quirúrgica por RVS post-IAM. Reportaron una tasa de mortalidad general intrahospitalaria a 30 días del 42.9%, con una marcada disminución con el cierre diferido (54.1% de mortalidad con reparación quirúrgica en los primeros siete días vs. 18.4% después de este tiempo). Los factores de riesgo que incrementaron la mortalidad transoperatoria incluyeron la edad, sexo femenino, choque, infarto inferior, uso de balón de contrapulsación intraaórtico (BIAC), diálisis, insuficiencia mitral, reoperación, cirugía de emergencia y tiempo de la reparación4. La mortalidad fue más alta (60%) en pacientes que fueron operados en las primeras 24 h, de acuerdo con otros investigadores7,8.
En el estudio de cohorte retrospectivo multicéntrico internacional CAUTION (The Mechanical Complications of Acute Myocardial Infarction: an International Multicenter Cohort) se incluyeron pacientes que fueron tratados quirúrgicamente por complicaciones mecánicas derivadas del IAM. El estudio incluyó 475 pacientes que fueron sometidos a cirugía por RVS postinfarto de 26 centros de diferentes países, en el periodo comprendido de enero 2001 a diciembre 2019. Los principales hallazgos de este estudio fueron los siguientes: a) la tasa de mortalidad temprana fue del 40.4%; b) la edad avanzada, el paro cardiaco preoperatorio, la revascularización percutánea y el requerimiento postoperatorio de BIAC o oxigenación por membrana extracorpórea (ECMO) se asociaron de forma independiente con la mortalidad temprana; c) los tiempos más prolongados entre el IAM, RVS y la reparación quirúrgica se asociaron con menor mortalidad, y d) la RVS recurrente no se asoció con una mayor mortalidad9. El momento óptimo de la reparación quirúrgica definitiva sigue siendo difícil de elucidar. Las guías del Colegio Americano del Corazón (ACC) y la AHA recomiendan reparación quirúrgica de emergencia independientemente del estado hemodinámico del paciente, por lo que el tiempo ideal permanece controversial y debe ser individualizado. En pacientes estables sin falla orgánica y anatomía favorable se debe considerar la reparación temprana. En pacientes estables pero con anatomía compleja o con tejidos friables debe considerarse retrasar la intervención5. El mecanismo fisiopatológico consiste en una necrosis miocárdica transmural excesiva, seguida de la rotura o cicatrización extensa del tejido afectado. El mecanismo convencional de la RVS involucra la necrosis de coagulación del tejido isquémico con infiltración de neutrófilos, causando el adelgazamiento y la debilidad del miocardio septal; este proceso subagudo requiere de tres a cinco días. Por otro lado, la rotura que se produce dentro de las 24 h de la presentación es más probable debido a la disección de un hematoma intramural o hemorragia en el miocardio isquémico8.
En la reparación temprana, la intervención se realiza alrededor del área infartada en el tejido miocárdico friable, lo que aumenta la posibilidad de expandir el tamaño de la RVS. Esto explicaría la elevada tasa de mortalidad intrahospitalaria comparada con el cierre diferido6.
El retraso la intervención tiene un fundamento mecánico; posterior al infarto la actividad de las metaloproteinasas y la degradación tisular alcanzan su punto máximo en el séptimo día, mientras que el depósito de colágeno nuevo comienza entre los días 2 y 4; los miocitos necróticos se reemplazan completamente por colágeno a los 28 días. Por lo tanto, el diferimiento podría facilitar el cierre exitoso al permitir que el tejido friable se organice, fortalezca y se diferencie bien de la actividad del tejido sano circundante, y el pico de descomposición del tejido ocurra en el séptimo día. El tejido conectivo y la formación de la cicatriz alrededor del defecto resulta en un mejor anclaje para el material de sutura y en menor potencial de dehiscencia del parche5. En la reparación quirúrgica se debe realiza la revascularización miocárdica en primera instancia, para priorizar la protección miocárdica. Las técnicas incluyen la de Dagget, el cierre primario del defecto y la técnica de David, que consta en la colocación de parche de endocardio con exclusión de infarto, que es en la actualidad la más utilizada en el mundo5. Para la RVS anterior, el área infartada del ventrículo izquierdo anterolateral se debe incidir de forma paralela a la DA, ya que el defecto septal se localiza generalmente por debajo de la incisión. Se debe emplear un parche de pericardio o material sintético con suturas en U con pledgets en el área no infartada del ventrículo derecho, para que toda la porción del septum del VI sea excluida del anillo mitral hacia la pared del VI anterolateral. Las RVS apicales verdaderas se pueden reparar y realizar un cierre primario amputando el ápex. Las RVS posteriores se abordan a través de la ventriculotomía en la pared del VI posterior infartada paralela a la descendente posterior, suturando un parche a la cara del VI del septum no infartado con cierre con parche, cierre primario o exclusión del infarto, dependiendo qué tanta pared libre del VI esté comprometida5. Si se opta por el cierre diferido, los dispositivos de asistencia ventricular (VAD) han demostrado ser un puente útil hacia la cirugía, mediante la disminución de la poscarga y precarga, ayudando a incrementar la perfusión coronaria en el miocardio afectado. La ECMO veno-arterial ha demostrado igualmente numerosos beneficios comparado con los VAD, ya que previenen la esternotomía, proporcionan apoyo en oxigenación y es fácilmente reversible; permite estabilización hemodinámica, recuperación o prevención de falla orgánica, lavado del efecto dual antiagregante y resulta una estrategia para tomar decisiones4. En la actualidad, los dispositivos de cierre percutáneo permiten un manejo menos invasivo en este tipo de pacientes; en casos seleccionados (defectos < 1.5 cm, etapa subaguda y pobres candidatos a cirugía) parecerían una opción más viable. Sin embargo, en una serie de casos de 29 pacientes con este tipo de manejo, el 41% experimentaron complicaciones relacionadas con el procedimiento y la tasa de supervivencia general a los 30 días fue del 35%, con mortalidad más elevada en pacientes con choque cardiogénico6.
Conclusiones
La RVS postinfarto sigue siendo una condición grave con un tratamiento médico y quirúrgico desafiante; a pesar de los múltiples avances en el manejo del infarto y en las técnicas quirúrgicas de reparación, la tasa de mortalidad no ha cambiado significativamente en décadas. De acuerdo con las bases de datos y cohortes revisados, se ha observado un mejor pronóstico con el cierre diferido10; sin embargo, se requieren más estudios prospectivos que incluyan no solo mejoría en las técnicas quirúrgicas, sino el manejo preoperatorio, con la finalidad de mejorar la actual tasa subóptima de mortalidad temprana. En nuestro instituto, tomando en cuenta los reportes de literatura y experiencia de nuestro centro, el algoritmo de manejo para esta complicación mecánica consiste en ingresar al paciente en la unidad coronaria de cuidados intensivos, optimización de tratamiento farmacológico, apoyo con soporte ventricular y realizar la reparación quirúrgica tras 14 días después del evento. En caso de inestabilidad hemodinámica, se considera la intervención con soporte circulatorio mecánico y corrección quirúrgica posterior a siete días, ya que se obtienen resultados satisfactorios.
Agradecimientos
Los autores agradecen al Servicio de Cirugía Cardiotorácica de la Unidad Médica de Alta Especialidad, Hospital de Cardiología del Centro Médico Nacional Siglo XXI, por compartir la información solicitada del caso clínico.
Financiamiento
Los autores declaran no haber recibido financiamiento para este estudio.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales
Confidencialidad, consentimiento informado y aprobación ética. Los autores han seguido los protocolos de confidencialidad de su institución, han obtenido el consentimiento informado de los pacientes, y cuentan con la aprobación del Comité de Ética. Se han seguido las recomendaciones de las guías SAGER, según la naturaleza del estudio.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.
