Introducción
Las micobacterias no tuberculosas constituyen un grupo diverso de bacilos ácido-alcohol resistentes ampliamente distribuidos en el ambiente1. A diferencia de Mycobacterium tuberculosis, las micobacterias no tuberculosas no se transmiten de persona a persona, y por lo general solo causan enfermedad en individuos con alteraciones estructurales pulmonares o con inmunocompromiso1.
Mycobacterium scrofulaceum pertenece al grupo de micobacterias no tuberculosas de crecimiento lento, clasificadas como escotocromógenas (grupo II de Runyon), y se ha asociado históricamente con linfadenitis cervical en población pediátrica2. La infección diseminada por M. scrofulaceum en adultos es infrecuente3,4. Se han documentado manifestaciones pulmonares, cutáneas, ganglionares y sistémicas, principalmente en pacientes inmunocomprometidos1,4.
El diagnóstico suele ser desafiante, ya que por la clínica puede simular tuberculosis, enfermedades neoplásicas o infecciones por otros patógenos oportunistas5. Su confirmación requiere habitualmente estudios microbiológicos especializados o técnicas moleculares5.
A continuación, presentamos el caso de una paciente con infección por el virus de la inmunodeficiencia humana (VIH) y adenopatías generalizadas en quien se documentó linfadenitis granulomatosa secundaria a M. scrofulaceum. La evolución clínica favorable con tratamiento antimicrobiano destaca la necesidad de incluir esta enfermedad en el diagnóstico diferencial en pacientes inmunocomprometidos.
Caso clínico
Mujer de 35 años con diagnóstico de infección por VIH de 1 mes de evolución, con un conteo inicial de CD4 de 36 células/μl y una carga viral de 1,200,000 copias/ml. Inició tratamiento antirretroviral con emtricitabina, tenofovir alafenamida y bictegravir. Acudió al servicio de urgencias por un cuadro de 3 semanas de evolución caracterizado por dolor abdominal difuso, tipo cólico, no relacionado con la ingesta de alimentos, que se exacerbaba con el movimiento y mejoraba parcialmente con analgésicos. Como síntomas acompañantes refería náusea, vómito, fiebre no cuantificada y pérdida de peso no intencionada de 5 kg en 3 semanas.
A su ingreso, se encontraba hemodinámicamente estable, sin datos de dificultad respiratoria ni focalización neurológica. En la exploración física se identificó una adenopatía supraclavicular izquierda, móvil, dolorosa, de aproximadamente 1.5 cm de diámetro. El abdomen se encontraba distendido, con dolor generalizado a la palpación media y peristalsis disminuida.
Los estudios de laboratorio iniciales revelaron anemia leve (hemoglobina 11.3 g/dl), leucocitosis (13.04 × 10³/μl) con neutrofilia (10.43 × 10³/μl), linfocitopenia relativa (linfocitos absolutos 1.04 × 10³/μl), hipoalbuminemia y proteína C reactiva elevada (17.85 mg/dl). El nuevo conteo de CD4 mostró mejoría inmunitaria, con aumento a 126 células/μl, y la carga viral fue de 562 copias/ml.
Se realizó tomografía computarizada de tórax, abdomen y pelvis con contraste doble, en la que se observaron adenopatías mesentéricas e inguinales, así como conglomerados ganglionares supraclaviculares. Posteriormente, una tomografía computarizada por emisión de positrones mostró hipermetabolismo en múltiples grupos ganglionares (supraclaviculares, mesentéricos, paraaórticos, retrocavos e ilíacos), con un SUV máximo de 14.3, hallazgos compatibles con proceso infeccioso o neoplásico (Fig. 1).

Figura 1. Tomografía computarizada por emisión de positrones que muestra adenopatías y conglomerados ganglionares supra- e infradiafragmáticos hipermetabólicos.
Ante la sospecha de enfermedad granulomatosa, se realizó una biopsia escisional de un conglomerado ganglionar supraclavicular izquierdo (2 × 2 cm). El estudio histopatológico mostró linfadenitis crónica granulomatosa con células gigantes multinucleadas, y las tinciones de Ziehl-Neelsen y de auramina fueron positivas para bacilos ácido-alcohol resistentes (Fig. 2). El cultivo de tejido ganglionar en medio específico para micobacterias resultó positivo y el aislamiento fue identificado como M. scrofulaceum mediante secuenciación genética, que consistió en la amplificación y la secuenciación de regiones génicas específicas, comparadas con bases de datos de referencia. El antibiograma reveló sensibilidad a la claritromicina y la rifabutina, y resistencia intermedia a la amikacina (Tabla 1).
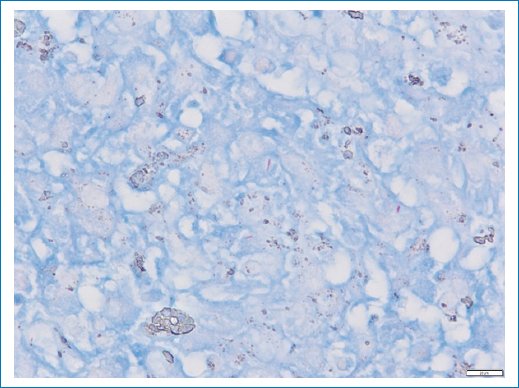
Figura 2. Presencia de bacilos ácido-alcohol resistentes en la tinción de Ziehl-Neelsen.
Tabla 1. Sensibilidades y resistencias de Mycobacterium scrofulaceum aislado
| Antimicrobiano | CMI (μg/ml) | Interpretación |
|---|---|---|
| Amikacina | 32 | Intermedio |
| Ciprofloxacino | > 8 | Resistente |
| Claritromicina | 4 | Sensible |
| Clofazimina | 0.25 | |
| Doxiciclina | > 8 | Resistente |
| Linezolid | 32 | Resistente |
| Minociclina | > 8 | Resistente |
| Moxifloxacino | > 4 | Resistente |
| Rifabutina | 2 | Sensible |
| Rifampicina | > 4 | Resistente |
| Estreptomicina | > 32 | |
| Trimetoprima-sulfametoxazol | > 4/76 | Resistente |
|
Interpretaciones basadas en las guías del Clinical & Laboratory Standards Institute (CLSI); clofazimina y estreptomicina no disponibles en ellas. CMI: concentración mínima inhibitoria. |
||
Inicialmente, el tratamiento se instauró con rifampicina, isoniazida, etambutol, pirazinamida y claritromicina, utilizando la formulación combinada disponible y de acuerdo con las guías internacionales. Dada la interacción farmacológica de la rifampicina y el bictegravir, se modificó el esquema antirretroviral sustituyendo bictegravir por dolutegravir en dosis doble.
La presentación clínica fue compatible con un síndrome inflamatorio de reconstitución inmunitaria, dado que la paciente desarrolló manifestaciones inflamatorias significativas durante el primer mes posterior al inicio de la terapia antirretroviral, coincidiendo con un descenso logarítmico de la carga viral y un incremento sustancial en el conteo de linfocitos CD4+. Por ello, se decidió iniciar corticosteroides sistémicos (prednisona, 50 mg diarios con reducción progresiva) con el objetivo de modular la respuesta inmunitaria excesiva, prevenir el daño tisular y favorecer la recuperación clínica.
El tratamiento se mantuvo durante 12 meses, con seguimiento clínico y laboratorial periódico. La paciente refirió mejoría clínica importante y durante el seguimiento se mantuvo afebril, sin recaídas ni efectos adversos al tratamiento. Una tomografía computarizada de control a las 8 semanas mostró resolución completa de las adenopatías mesentéricas y supraclaviculares.
Discusión
M. scrofulaceum es una micobacteria no tuberculosa escotocromógena perteneciente al grupo II de Runyon, que se encuentra principalmente en el agua y el suelo, y rara vez genera enfermedad en los humanos1. Cuando la produce, la presentación clínica más común es la linfadenitis cervical, especialmente en niños inmunocompetentes2. Se trata de la presencia de ganglios indoloros, con crecimiento lento (semanas a meses), que pueden supurar. En pacientes inmunocomprometidos se han reportado infecciones pulmonares crónicas, lesiones cutáneas y enfermedad diseminada1,4.
La infección diseminada por M. scrofulaceum, descrita por primera vez en 1971, es rara, con aproximadamente 15 casos reportados en adultos, en general en pacientes con inmunosupresión por el VIH, uso de fármacos dirigidos contra el factor de necrosis tumoral o enfermedades hematológicas3–5.
El diagnóstico se establece mediante biopsia ganglionar, en la que se realizan pruebas como la tinción de Ziehl-Neelsen, que permite identificar bacilos ácido-alcohol resistentes, así como técnicas moleculares como la reacción en cadena de la polimerasa o la secuenciación de 16S rRNA para su identificación genética5. No obstante, el cultivo continúa siendo el método de referencia5.
Entre los diagnósticos diferenciales se incluyen el linfoma, la tuberculosis, la infección por Mycobacterium avium y otras enfermedades granulomatosas.
El tratamiento varía según la forma de presentación clínica. En los casos de adenitis cervical, el abordaje de elección es quirúrgico, mediante escisión completa del ganglio afectado, sin que sea estrictamente necesario el uso de antibióticos en todos los casos2.
En las presentaciones pulmonares o diseminadas, a diferencia de M. tuberculosis, no existe un esquema terapéutico estandarizado para las micobacterias no tuberculosas. Se han descrito combinaciones de rifampicina, etambutol, macrólidos, aminoglucósidos y fluoroquinolonas, con esquemas prolongados de hasta 12 meses1,3,4. Sin embargo, se recomienda individualizar el tratamiento según la sensibilidad del aislamiento3. En el caso aquí presentado se utilizó un esquema con rifampicina, isoniazida, etambutol, pirazinamida y claritromicina, basándose en los resultados de sensibilidad. Además, se indicó un esteroide sistémico (prednisona) con reducción progresiva de la dosis, y se observó una respuesta clínica y radiológica favorable a las 8 semanas.
Respecto al manejo del tratamiento antirretroviral, es fundamental considerar las interacciones farmacológicas relevantes con el esquema antituberculoso, en particular entre la rifampicina y el bictegravir, ya que esta reduce significativamente las concentraciones plasmáticas del inhibidor de la integrasa3. Por este motivo, se recomienda sustituir el bictegravir por un régimen compatible, como dolutegravir a dosis doble, tal como se hizo en nuestra paciente.
Este caso resalta la importancia de las micobacterias no tuberculosas en el diagnóstico diferencial de las linfadenopatías persistentes en pacientes inmunocomprometidos, en especial en caso de afección de múltiples ganglios o afección diseminada. El uso de estudios histopatológicos, cultivos especializados y pruebas moleculares es de gran relevancia para lograr un diagnóstico oportuno. El manejo debe individualizarse de acuerdo con la sensibilidad antimicrobiana y la respuesta clínica.
Conclusión
La infección por M. scrofulaceum en pacientes inmunocomprometidos es poco frecuente, pero debe considerarse dentro del diagnóstico diferencial de las linfadenopatías persistentes con manifestaciones sistémicas. El caso reportado destaca la importancia de una evaluación integral que incluya estudios histopatológicos y moleculares para lograr un diagnóstico etiológico. El tratamiento antimicrobiano puede lograr una respuesta clínica favorable, siempre y cuando el diagnóstico se establezca de manera temprana y oportuna.
Financiamiento
Los autores declaran no haber recibido financiamiento para este trabajo.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. Los autores han seguido los protocolos de confidencialidad de su institución, han obtenido el consentimiento informado de la paciente, y cuentan con la aprobación del Comité de Ética. Se han seguido las recomendaciones de las guías SAGER, según la naturaleza del estudio
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.
